Die meisten biopharmazeutischen Produkte unterliegen mit zunehmender Alterung einer Veränderung. Dennoch bleiben sie stabil, solange sie ihre Eigenschaften oder ihre Wirksamkeit beibehalten. Dieser Stabilitätszeitraum wird auch als Haltbarkeitsdauer bezeichnet. Die Haltbarkeitsdauer jedes Produkts hängt von den Daten ab, die bei den Stabilitätstests erhoben werden. Stabilitätsprüfungen sind die Versuchsprotokolle, die zur Datenerfassung verwendet werden und als Grundlage für die Beurteilung der Haltbarkeit dienen. Typische Lagerbedingungen für verpackte pharmazeutische Produkte, die entweder in Krankenhäusern verwendet oder rezeptfrei verkauft werden, sind +2 °C bis +8 °C, +15 °C bis +25 °C oder manchmal +2 °C bis +25 °C.
Ein Beispiel: Ergebnisse der beschleunigten Stabilitätsprüfung - Wirksamkeit eines biopharmazeutischen Produkts bei verschiedenen Temperaturen und über verschiedene Zeiträume hinweg.
 Temperaturabweichungen GXP-konform handhaben
Temperaturabweichungen GXP-konform handhaben
Indem Sie Informationen zur Stabilität in Datenloggern programmieren, können Sie die vorzeitige Entsorgung von Produkte verhindern.
Aber was ist ein Stabilitätsbudget überhaupt?
Das Konzept des Stabilitätsbudgets ist ein praktisches Management-Instrument, das jedem Partner in der Lieferkette für die Herstellung, Verpackung, Lagerung und den Vertrieb von biopharmazeutischen Produkten zugewiesen wird. Das Budget kann auf alle Arzneimittel angewandt werden, auch auf solche mit Lagerbedingungen bei -20 °C, +2 °C bis +8 °C und +15 °C bis +25 °C. Das Stabilitätsbudget kombiniert relevante Informationen aus Temperaturstudien mit verfügbaren Daten aus der Stabilitätsprüfung, um die Zeitspanne zu bestimmen, die ein Produkt ausserhalb seiner spezifizierten Lagerbedingungen verbringen kann, ohne dass seine Qualität, Sicherheit oder Wirksamkeit gefährdet ist.
Im Laufe des Produktzyklus durchläuft ein Produkt mehrere Stationen in der Lieferkette. Da bei jeder Etappe das Risiko von Temperaturschwankungen besteht, kann ein Stabilitätsbudget dazu beitragen, die Sicherheit des Produkts am Ende der Kette zu gewährleisten.
Darüber hinaus verhindert ein Stabilitätsbudget teure, zeitaufwändige Untersuchungen mit Auftragsforschungsinstituten (CRO) und Logistikdienstleistern (LSP). Verzögerungen können vermieden werden, weniger Produkte werden verworfen, und die Kosten werden gesenkt. Vor allem aber kann ein Stabilitätsbudget Engpässe bei Arzneimitteln verhindern und sicherstellen, dass wichtige Medikamente die Patienten rechtzeitig erreichen.
Wie ein Stabilitätsbudget bestimmt wird
Viele Pharmahersteller verwenden die Daten aus den umfangreichen Produktstabilitätsstudien, um die Mindest- und Höchsttemperaturen sowie die Gesamtzeit ausserhalb der Lagerbedingungen während des Transports zu bestimmen.
Der erste Schritt ist die Ermittlung der thermischen Stabilität eines Produkts. Die thermische Stabilität eines Produkts ist die Fähigkeit des Produkts, unter bestimmten Bedingungen irreversiblen Veränderungen seiner Identität, Stärke, Qualität und Reinheit bei verschiedenen Temperaturen oberhalb und unterhalb des spezifizierten Lagerbereichs zu widerstehen.
Wie man sich vorstellen kann, ist die Zeit von entscheidender Bedeutung, insbesondere bei der Entwicklung eines neuen Wirkstoffs. Daher verlassen sich die meisten Arzneimittelhersteller nicht nur auf Real-Time-Stabilitätsprüfungen, die Jahre dauern können, sondern führen auch beschleunigte Stabilitätsstudien durch. Dabei wird die Haltbarkeit mithilfe der Arrhenius-Gleichung prognostiziert. Bei diesen beschleunigten Tests werden die Produkte bestimmten erhöhten Temperaturen ausgesetzt (z. B. +25 °C, +30 °C, +40 °C). Die Wirksamkeit wird nach bestimmten Zeiträumen (z. B. sechs Tage, 28 Tage, drei Monate, 12 Monate, 24 Monate und 36 Monate) getestet. Diese Simulationen werden anschliessend analysiert, um die Auswirkungen von Temperaturschwankungen auf den Arzneimittelabbau zu ermitteln. Die Idee ist, das Worst-Case-Szenario durchzuspielen.
So wie ein Stabilitätsbudget es ermöglicht, die Sicherheit und Wirksamkeit des Produkts für den Patienten zu gewährleisten, ist der Erfolg nur durch das Engagement aller an der Lieferkette beteiligten Partner möglich.
Wer ist Eigentümer des Stabilitätsbudgets?
Der Eigentümer des Stabilitätsbudgets ist der Inhaber der Marktzulassung (MAH) - das Unternehmen, das die Zulassung eines Produkts für einen bestimmten Markt beantragt. Innerhalb dieses Unternehmens ist der natürliche Eigentümer die Qualitätsabteilung. Aus der Sicht des Dokuments oder der Daten ist das Stabilitätsbudget ein definierter Datensatz unter strenger Versionskontrolle, der in der Regel in einem PDF-Dokument erfasst und manchmal auch in einer speziellen Software gespeichert wird.
Wie oft ändert sich ein Stabilitätsbudget?
Stabilitätsbudgets und Verfallsdaten können sich im Laufe der Zeit erhöhen, allerdings nur in der frühen Phase I der klinischen Prüfungen für neue Arzneimittelwirkstoffe. Stabilitätsbudgets und Verfallsdaten werden normalerweise in klinischen Prüfungen der Phase II festgelegt. Sie bleiben für die Dauer der Phase II sowie bis zur kommerziellen Verwendung stabil. Es ist unwahrscheinlich, dass sich das Stabilitätsbudget oder das Verfallsdatum in späteren kommerziellen Phasen ändert. Das Verfallsdatum muss sowohl auf jeder Verkaufseinheit als auch auf dem Karton deutlich lesbar sein. So muss zum Beispiel jedes Fläschchen sowie der Karton, in dem die Fläschchen verpackt sind, beschriftet sein.
Wie führt man einen Stabilitätstest durch?
Stabilitätstests können die Zeit- und Temperaturspanne vergrössern, in der ein pharmazeutisches Produkt eingesetzt werden kann. Bei der Stabilitätsprüfung wird der Wirkstoff für eine bestimmte Zeit Temperaturen ausgesetzt, die ausserhalb der spezifizierten Lagerbedingungen liegen, und anschliessend auf seine Sicherheit und Wirksamkeit geprüft.
Es gibt zwei Arten von Stabilitätsprüfungen:
-
Bei der Real-Time-Stabilitätsprüfung wird ein Produkt unter den empfohlenen Lagerungsbedingungen gelagert und so lange überwacht, bis es die Spezifikation nicht mehr erfüllt. Ein solches Instrument ist die mittlere kinetische Temperatur (MKT). Dies kann sehr zeitaufwändig sein - und Zeit ist bei der Produktentwicklung von entscheidender Bedeutung.
-
Bei beschleunigten Stabilitätstests wird das Produkt bei erhöhten Temperaturen gelagert. Nach bestimmten Zeiträumen wird der Abbau des Produkts bewertet und mit der Vorhersage der bekannten Beziehung zwischen dem Beschleunigungsfaktor (Temperatur) und der Abbaugeschwindigkeit (Arrhenius-Gleichung) verglichen.
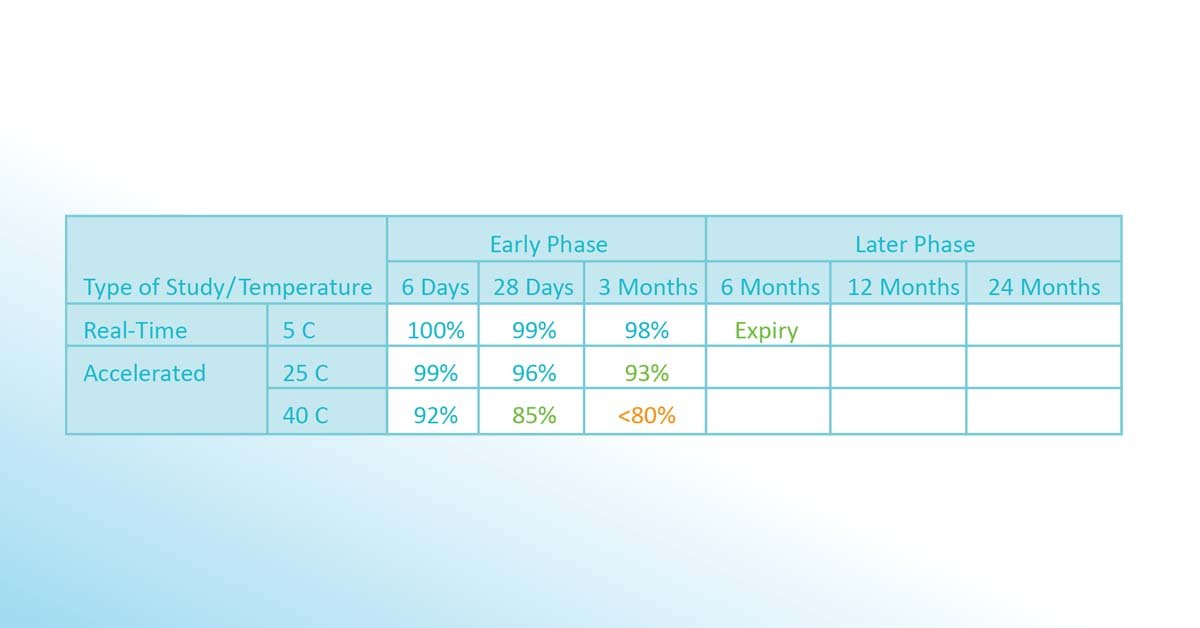
Verschiedene Lose oder Chargen der Substanz werden unterschiedlichen Temperaturen ausgesetzt. Nach verschiedenen Zeiträumen (6 Tage, 28 Tage, 3 Monate) wird eine Prüfung durchgeführt, wenn mehr als 80% des Wirkstoffs noch wirksam sind. Als Ergebnis dieser frühen Phase wird eine erste Version des Stabilitätsbudgets erstellt (im obigen Fall +8 °C bis +25 °C für 3 Monate, +25 °C bis +40 °C für 28 Tage). Da nach 3 Monaten noch mehr als 98% des Wirkstoffs wirksam sind, wird eine erste (konservative) Version des Verfallsdatums anhand der Arrhenius-Gleichung berechnet und auf 6 Monate festgelegt.
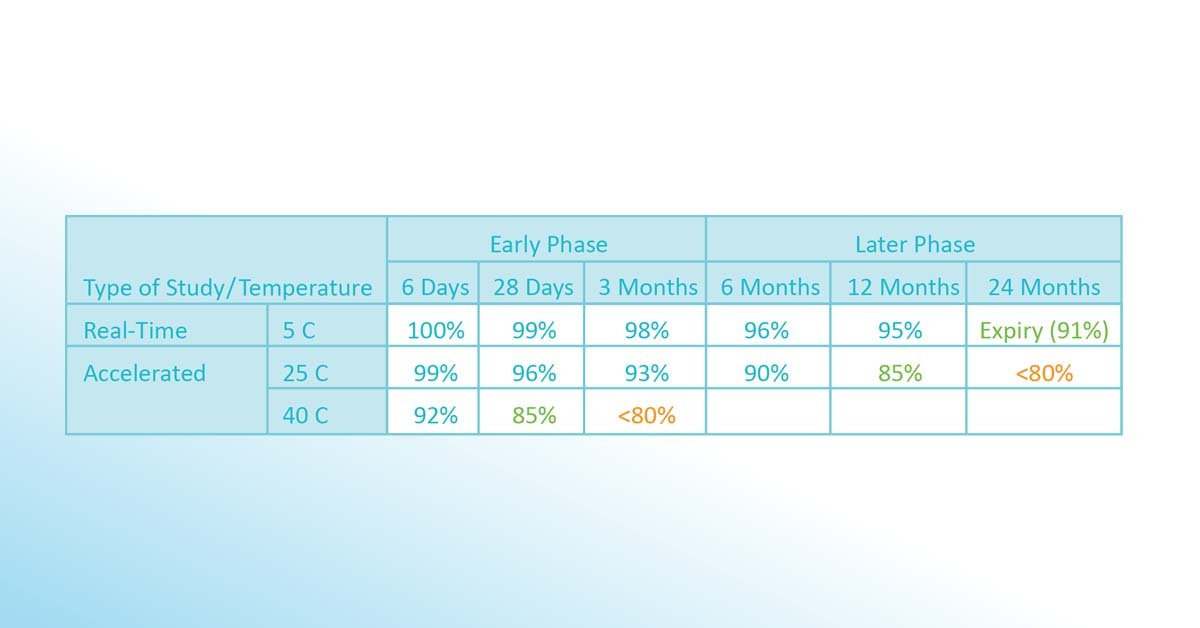
Dieselbe Substanz wird weiterhin denselben Temperaturen ausgesetzt (und nach unterschiedlichen Zeiträumen getestet), um festzustellen, ob der Inhaltsstoff noch zu mehr als 80% wirksam ist. Daraufhin wird eine neue Version des Stabilitätsbudgets erstellt (im obigen Fall +8 °C bis +25 °C für 12 Monate und weiterhin +25 °C bis +40 °C für 28 Tage). Nach 24 Monaten sind immer noch 91% der Wirksamkeit vorhanden, wenn sie bei +5 °C gelagert werden. Auf der Grundlage von Belastungstests und anderen Sicherheits- und Markterwägungen, wird das endgültige Verfallsdatum auf 24 Monate festgelegt.
 Auf Risiken vorbereitet sein
Auf Risiken vorbereitet sein
Erfahren Sie, was Experten zu Lieferengpässen, Prozessveränderungen, Fehlern bei der Distribution und zur Stabilität von Arzneimitteln sagen. Dies sind einige Aspekte, mit denen Sie sich befassen sollten, bevor Sie loslegen.
Sprechen wir über Temperaturüberwachung
Vereinbaren Sie noch heute einen Gesprächstermin mit unseren Experten. Wir sind für Sie da, um Ihr Kühlkettenüberwachungsprojekt zu unterstützen und zum Erfolg zu führen.