Temperaturüberwachung und GxP Compliance
Warum muss eine Temperaturüberwachungslösung sich an GxP-Richtlinien halten? Was hat Benutzer Management, Datenmanagement und Audit Trail damit zu tun?
Warum muss eine Temperaturüberwachungslösung sich an GxP-Richtlinien halten? Was hat Benutzer Management, Datenmanagement und Audit Trail damit zu tun?
Warum muss eine Temperaturüberwachungslösung sich an GxP-Richtlinien halten? Was hat Benutzer Management, Datenmanagement und Audit Trail damit zu tun?
Wenn ein Unternehmen pharmazeutische Produkte erforschen, herstellen, lagern, transportieren oder verkaufen will, unterliegt es den gesetzlichen Bestimmungen.
Die gängigsten bekannten Praktiken sind:
Wenn ein Unternehmen pharmazeutische Produkte erforscht, produziert, lagert, transportiert oder verkauft, unterliegt es den gesetzlichen Anforderungen. Die Gesetze und Vorschriften sind länderspezifisch und umfassen in der Regel eine nationale oder internationale Behörde wie die FDA (in den USA), die EU (in Europa) oder Swissmedic (in der Schweiz), die alle vom ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) koordiniert werden.
Neben den behördlichen Vorschriften gibt es eine Reihe wichtiger Verbände, die Leitfäden herausgeben, die die Vorschriften und deren Anwendung in bestimmten Situationen unterstützen und detaillieren. Einige der einflussreichsten Organisationen, die für die pharmazeutische Lieferkette relevant sind, sind die ISPE (International Society for Pharmaceutical Engineering), die USP (United States Pharmacopeia), die PDA (Parental Drug Association) und die WHO (Weltgesundheitsorganisation). Der Rechtsrahmen ist somit ein lebendiger Organismus, der sich fast täglich ändert, wenn neue Gesetze in Kraft treten und neue Leitfäden veröffentlicht werden.
Aus Sicht der Arzneimittelversorgungskette sind die Eckpfeiler des Rechtsrahmens das Good Manufacturing Practice System (GMP) und das Good Distribution Practice System (GDP) - oder oft gemeinsam als GxP bezeichnet. Während sich GMP auf Aktivitäten rund um die Herstellung von Medikamenten (einschließlich Prüfung, Freigabe und Lagerung) konzentriert, konzentriert sich GDP auf den Vertrieb von Medikamenten einschließlich Transport, Lagerung und Großhandel von Arzneimitteln. Sowohl GMP als auch GDP zielen darauf ab, die öffentliche Gesundheit durch die Sicherstellung der Produktqualität zu verbessern.
Zusammengefasst kann man sagen:
Wenn pharmazeutische Produkte gemäss den GMP- und GDP-Richtlinien gelagert oder transportiert werden, müssen folgende Richtlinien eingehalten werden:
- Die Produkte dürfen nur in qualifizierten Einrichtungen (z.B. Lagerhäuser, Transportfahrzeuge) produziert, gelagert und transportiert werden.
- Die Temperaturen müssen durch ein Überwachungssystem, welches compliant ist, überwacht werden (Audit-Trail).
- und die Datenlogger der Temperaturüberwachungslösung müssen regelmäßig kalibriert werden.
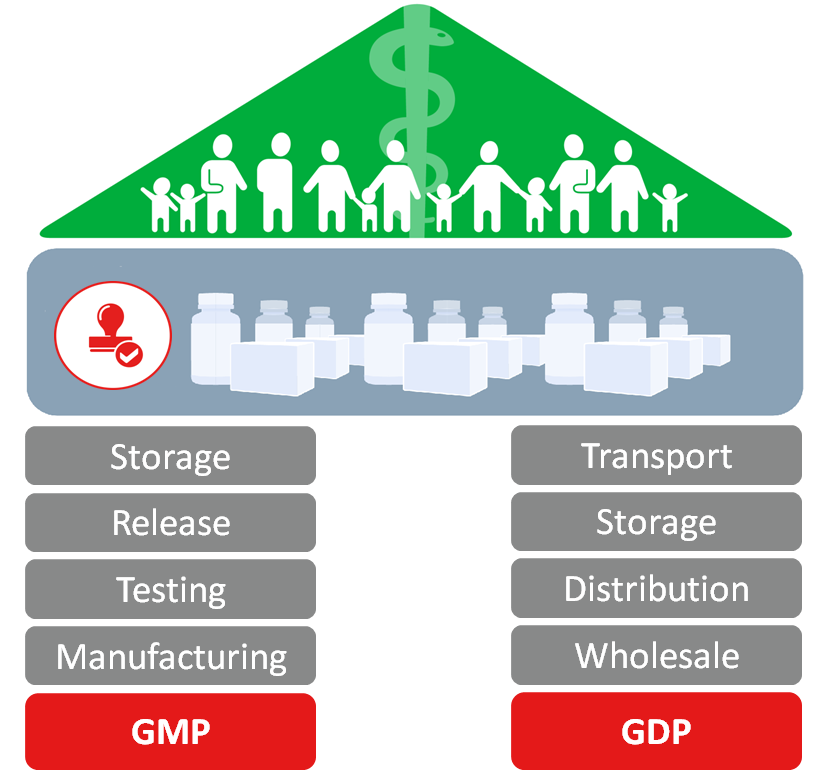
Wenn ein Unternehmen pharmazeutische Produkte lagert oder transportiert und die GMP- und GDP-Richtlinien einhalten will, muss es die Produkte in qualifizierten Einrichtungen produzieren, handhaben, lagern und transportieren. Zusätzlich müssen Kalibrierte Sensoren in den Einrichtungen installiert werden, die ihre Temperaturwerte an ein GxP-konformes Überwachungssystem melden. Aber was bedeutet GxP Compliance in Kombination mit einer Temperaturüberwachungslösung? In der folgenden kurzen Zusammenfassung werden alle Elemente und Funktionen einer GxP-konformen Temperaturüberwachungslösung aufgewiesen.
"Artikel 21 CFR Abschnitt 11" ist der Teil des "Code of the Federal Regulations" der United States Food and Drug Administration (FDA). Artikel 21 enthält Vorschriften über elektronische Aufzeichnungen und elektronische Signaturen. Abschnitt 11 definiert die Kriterien, nach denen elektronische Aufzeichnungen und elektronische Signaturen als vertrauenswürdig, zuverlässig und gleichwertig zu Papieraufzeichnungen gelten, um die Einhaltung der Vorschriften zu gewährleisten.
Eine Temperaturüberwachungslösung, die elektronische Aufzeichnungen speichert, welche für die Patientensicherheit entscheidend sind, muss Artikel 21 CFR Part 11 entsprechen. Um dies zu erreichen, ist es wichtig, die wichtigsten Risiken zu verstehen.
Elektronische Daten können gelöscht sowie versehentlich oder absichtlich geändert werden. Artikel 21 CFR Part 11 definiert Kriterien, nach denen elektronische Daten vertrauenswürdig, zuverlässig und gleichwertig zu Papierakten mit eigenhändigen Unterschriften sind. Wenn Sie folgende Regeln befolgen, sind Ihre elektronischen Aufzeichnungen vollständig, intakt, im ursprünglichen Kontext gepflegt und auf Compliance ausgerichtet.
Vollständige Daten - Wird Temperaturüberwachung mit Hilfe von Sensoren, einer Kommunikationsbrücke und der Softwarelösung geregelt, ist eine der größten Herausforderungen die Vollständigkeit der Daten. Es müssen Mechanismen vorhanden sein, um die Einhaltung der Vorschriften zu gewährleisten, damit keine Daten auf dem Weg von den drahtlosen Sensoren über die Kommunikationsbrücke bis hin zur Überwachungssoftware verloren gehen. Daher müssen im Falle einer Trennung zwischen den Sensoren und der Funkbrücke (oder dem Cloud-Speicher) Daten in den Sensoren gepuffert werden, bis die Cloud bestätigt, dass die Verbindung wieder hergestellt wurde und die Daten angekommen sind.
Bei der Überwachung von Daten in einer Kühlkettenumgebung ist die Vollständigkeit der Daten DIE Hauptsorge und Ursache für Probleme. Daher sollte die Kühlketten-Datenbank Mechanismen zur Minderung der folgenden Risiken enthalten:
Intakte Daten - Obwohl das Risiko einer versehentlichen oder absichtlichen Änderung minimal ist, kann die Integrität der Daten in einer Messkette nur durch Verschlüsselung der Daten vom messenden Funksensor über die Kommunikationsbrücke bis hin zur Cloud erreicht werden. Nach dem Eintreffen der Daten in der Software ist es wichtig, dass keine Rohdaten gelöscht oder verändert werden können. Nicht jeder Benutzer sollte in der Lage sein, die Rohdaten zu ändern, aber es ist möglich, bestimmte Arten von Zusatzinformationen hinzuzufügen. Um beispielsweise eine Interpretation der Daten zu ergänzen, können dem System bestimmte Kommentare oder Bestätigungen zu den Rohdaten hinzugefügt werden. Darüber hinaus können Berichte erstellt und exportiert werden, um selektive Ansichten der Rohdaten zu erstellen.
Elektronische Daten in ihrem ursprünglichen Kontext erhalten - Die Aufbewahrung der Daten in einer einzigen Quelle auf einer zentralen Cloud-Infrastruktur stellt sicher, dass die Daten in ihrem ursprünglichen erfassten Kontext gehalten werden und somit das Risiko von Fehlinterpretationen ausgeschlossen ist. Warnungen, Alarme und Berichte sollten sich immer auf den eindeutigen Sensornamen, die Ereignisnummer und den Zeitstempel beziehen.
Laden Sie eine Checkliste herunter, mit allem was Sie über Cloud-basierte Temperaturüberwachung wissen müssen.
Wir haben hier alles, was Sie über Temperaturüberwachung wissen müssen, zusammengefasst.
Es gibt viele Regeln zu beachten, wenn es um die Einhaltung von Vorschriften in der Benutzerverwaltung geht. Jeder Benutzer mit Zugriff auf die Lösung muss durch einen eindeutigen Benutzernamen und ein eindeutiges Passwort identifiziert werden und eine klare Rolle und Rechte haben. Darüber hinaus muss jede Aktion, die der Benutzer im System durchführt, identifiziert und nachvollziehbar sein. Bei kritischen Vorgängen wie der Quittierung eines Alarms muss der Benutzer seine Aktion sogar durch erneute Eingabe seines Passworts bestätigen. Um unbefugten Zugriff zu vermeiden, ist es außerdem wichtig, einen Timeout-Mechanismus zu implementieren, falls der Benutzer über einen längeren Zeitraum keine Aktion durchführt.
Das Ergebnis der oben genannten Tracking-Funktionalitäten ist ein vollständiger Audit-Trail, der auf GxP Compliance ausgerichtet ist: Wer hat was getan und warum? Technisch gesehen verfolgt der Audit-Trail jedes einzelne automatisierte Ereignis, welches das System erzeugt, und jede einzelne manuelle Aufgabe, die ein Benutzer ausführt. Egal aus welcher Perspektive man also einen Blick in das System wirft, könnte ein vollständiger Audit-Trail folgende Informationen beinhalten:
Ein Temperaturüberwachungssystem führt typischerweise die folgenden verschiedenen automatisierten Mechanismen und Workflows aus:
Zusätzlich zu den automatisierten Ereignissen muss das System jede einzelne manuelle Aufgabe, die ein Benutzer ausführt, einschließlich der Zeitstempel jeder Aufgabe verfolgen. Die folgenden manuellen Ereignisse können nachvollzogen werden:
In einer Kühlketten-Datenbank ist die Frage des Audit-Trails viel komplexer als bei einer Lösung, die Räume und Ausrüstung überwacht. Warum? Weil viel mehr Teilnehmer einbezogen sind:
Die Kühlketten-Datenbank muss einen auf die Einhaltung der Vorschriften abgestimmten Prüfpfad führen: Wer hat was und warum getan? Noch wichtiger ist es jedoch, die Benutzerrechte einzuschränken, um beabsichtigte oder unbeabsichtigte Änderungen zu verhindern, die nicht unbedingt notwendig sind, um den spezifischen Prozess in der gegebenen Situation durchzuführen. Ein vollständiger Kühlketten-Audit-Trail könnte sein:
Der Internationale Luftverkehrsverband (IATA) hat erkannt, dass die pharmazeutische Industrie versucht, wann immer möglich den Lufttransport zu vermeiden: "Ein Großteil aller Temperaturabweichungen, die auftreten, geschieht, während sich das Paket in den Händen von Fluggesellschaften, Flughäfen und ihren Auftragnehmern befindet. Vor mehr als 15 Jahren hat die IATA deshalb die Time and Temperature Working Group (TTWG) ins Leben gerufen, die die Temperature Control Regulations (TCR) formuliert hat - ein Leitfaden, der es den am Transport und der Handhabung temperaturempfindlicher Produkte beteiligten Akteuren ermöglichen soll, die Anforderungen der pharmazeutischen Industrie zu erfüllen. Der Leitfaden hat dazu beigetragen, das Bewusstsein der gesamten Logistikbranche zu schärfen - mit der Einführung des Labels "Time & Temperature Sensitive", das heute ein bekannter Standard ist.
Aber die IATA hat erkannt, dass die Erfindung eines Labels nicht ausreicht, und hat ein Zertifizierungsprogramm geschaffen: das Center of Excellence for Independent Validators in Pharmaceutical Logistics (CEIV Pharma). Ziel des CEIV-Pharma-Programms ist es, die Luftfracht-Lieferkette bei der Erzielung einer hervorragenden pharmazeutischen Handhabung zu unterstützen und die Sicherheit, Compliance und Effizienz durch die Schaffung einer weltweit einheitlichen und anerkannten Zertifizierung für die Handhabung pharmazeutischer Produkte zu erhöhen. Flughäfen, Handelswege, Dienstleistungsanbieter und ganze Netzwerke können wir nun durch die Schulung von Personal, die Verbesserung der Ausrüstung und die Einführung von Checklisten und Prozessen zertifizieren.
GMP und GDP erfordern eindeutig die Qualifizierung aller Geräte, die zur Herstellung, Lagerung und zum Transport temperaturempfindlicher Arzneimittel verwendet werden - und dazu gehören auch Datenlogger. Als pharmazeutisches Unternehmen, das einen Datenlogger und/oder eine Kühlketten-Datenbank verwendet, müssen Sie nachweisen, dass es den beabsichtigten Zweck erfüllt.
Qualifizierung ist der dokumentierte Nachweis durch den Inhaber der Marktzulassung (MAH), dass die Kühlkettenüberwachungslösung den beabsichtigten Zweck erfüllt: die Dokumentation einer Freigabeentscheidung.
Das Unternehmen, das die Kühlkettenüberwachungslösung einsetzt, muss diese Qualifizierungsarbeit selbst und individuell für den spezifischen Prozess durchführen. Die Qualifizierungsdokumentation des Unternehmens zur Überwachung der Kühlkette ist ein beliebtes Ziel bei FDA-Audits. Die Qualifizierung einer Kühlkettenüberwachungslösung in einer bestimmten Situation kann einfach gehalten werden, wenn der Lieferant alle Elemente der Lösung (Hardware, Software, Dienstleistungen) vorher qualifiziert und eine profunde Dokumentation darüber vorlegt. Obwohl Qualifizierung der bessere Begriff ist, wird diese Aktivität oft als "Komponentenvalidierung" bezeichnet.
Jede Komponente, die in einer Kühlkettenüberwachungslösung verwendet wird, muss vom Lieferanten validiert/qualifiziert werden. Er muss den dokumentierten Nachweis erbringen, dass jede Komponente ihren beabsichtigten Zweck erfüllt.
Gut ausgearbeitete Qualifizierungs-Unterstützungspakete, die von den Anbietern von Datenloggern bereitgestellt werden, umfassen:
Der Lieferant bietet in der Regel Anleitung während der Qualifizierung und ist offen für Audits. Während der Audits können die detaillierten V-Modell-Dokumente eingesehen werden.
GMP- und GDP-Standards definieren, dass pharmazeutische Produkte gemäß den auf dem Arzneimitteletikett angegebenen erforderlichen Temperaturbedingungen gelagert und transportiert werden müssen, um die Einhaltung der Vorschriften zu gewährleisten. Jede Abweichung von diesen Temperaturbedingungen muss dokumentiert werden. Das Überwachungssystem sollte den Benutzer bei der Erstellung automatisierter Exkursionsberichte unterstützen, zu denen der Benutzer noch bestimmte Informationen hinzufügen kann. Das folgende Verfahren gibt ein Beispiel dafür, welche Fragen ein Qualitätsmanager stellen sollte, nachdem eine Temperaturabweichung stattgefunden hat.
GMP- und GDP-Standards legen fest, dass pharmazeutische Produkte unter den auf dem Arzneimitteletikett angegebenen Temperaturbedingungen gelagert und transportiert werden müssen, um die Einhaltung der Vorschriften zu gewährleisten. Jede Abweichung dieser Temperaturbedingungen ist zu dokumentieren. Das Temperaturüberwachungssystem sollte den Benutzer bei der Erstellung automatisierter Temperatur Schwankungsberichte unterstützen, zu denen der Benutzer noch bestimmte Informationen hinzufügen kann. Die folgende Vorgehensweise gibt ein Beispiel dafür, welche Fragen ein Qualitätsmanager stellen sollte, wenn eine Temperaturänderung aufgetreten ist.
ALARM WIRD AUSGELÖST
Eine Temperaturveränderung löst einen Alarm aus. Der Alarm ist am Sensor selbst oder auf dem Dashboard-Display sichtbar und kann per E-Mail oder SMS mit den folgenden Informationen versendet werden:
Wo ist der Alarm ausgelöst worden? Welche Anlage, welcher Container oder Sensor hatte eine Schwankung?
Wann ist die Temperaturschwankung aufgetreten und wann wurden die Temperaturbedingungen der Medikamentenkennzeichnung wiederhergestellt?
Wie lange ist das Produkt schon Temperaturen außerhalb der Medikamentenkennzeichnung ausgesetzt?
Was war die höchste/niedrigste Temperatur die gemessen wurde?
Risiken? Ist es wahrscheinlich, dass die Kerntemperatur des Produkts beeinflusst und das Produkt dadurch beschädigt wurde?
Schweregrad? Gibt es noch genügend Stabilitätsbudget, um eine Freigabe des Produkts zu rechtfertigen, oder ist ein Produktrückruf erforderlich?
Erforderliche Korrekturmassnahmen? Was ist die Ursache für den Temperaturunterschied und muss er korrigiert werden? Müssen die Menschen über die Ergebnisse informiert werden?
Braucht es Präventivmassnahmen? Im Falle von hoch riskanten und/oder sich wiederholenden Fehlern: Welche Präventivmaßnahmen können durchgeführt werden, um eine Wiederholung des Ereignisses zu vermeiden? Werden Änderungen umgesetzt?
Ein Dashboard gibt einen kurzen Überblick über den aktuellen Status der einzelnen Sensoren. Die Sensoren können sinnvoll gruppiert oder auf einem Grundriss platziert werden, um ihren physikalischen Standort zu veranschaulichen. Das Dashboard sollte den aktuellen Messwert und den Alarmstatus anzeigen und weitere aussagekräftige Informationen über den technischen Zustand des Sensors liefern. Die Vorteile eines Dashboards sind:

Neben einem klaren Alarmmechanismus ist es wichtig, eine regelmäßige Berichterstattung über alle Sensoren eines Systems zu haben. Jeder Bericht kann einen anderen Zweck haben und deshalb wird jeder Bericht einen anderen Inhalt haben. Wenn der Bericht als Datenarchiv dient, sollte der Bericht ein Dokument sein, das den ISO-Normen für die Langzeitarchivierung entspricht. Wenn der Bericht an Kunden gesendet wird, kann es wichtig sein, verschiedene Sensoren miteinander zu kombinieren, um den idealen Überblick über das Projekt des Kunden zu erhalten. Zusammenfassend lässt sich sagen, dass einige Beispiele für regelmäßige Berichte sein könnten:
Die Archivierung ist in den GxP-Vorschriften nicht klar definiert und bleibt offen für die eigene Interpretation. Viele Menschen haben die eher unrealistische Vorstellung, dass Daten, die einmal archiviert sind, für immer verfügbar sein sollten, so wie sie generiert wurden. Die Datenarchivierung ist der Prozess des Verschiebens von Daten, die nicht mehr aktiv genutzt werden, auf ein separates Speichermedium zur langfristigen Aufbewahrung. Archivdaten bestehen aus älteren Daten, die für das Unternehmen wichtig bleiben oder für zukünftige Referenzgründe oder zwecks Gesetzeskonformität aufbewahrt werden müssen. Daher haben "Archivdaten" eine andere Form als "Prozessdaten".
Prozessdaten sind "frische Daten", die zur Durchführung von Geschäftsentscheidungen verwendet werden (z.B. Daten eines Produkts, Berechnung der mittleren kinetischen Temperatur einer Stabilitätsstudie). Der Dienstleister muss sicherstellen, dass für die letzten zwei Jahre Prozessdaten für Visualisierungen (z.B. Zoom, Overlay), Statistiken (z.B. MKT berechnen), Berichte (z.B. Freigabeentscheidung) und Exporte der Daten (z.B. an ein übergeordnetes Batch-Management-System) elektronisch verfügbar sind. Darüber hinaus muss es möglich sein, Kommentare zu den Daten im System hinzuzufügen.
Nach den ersten zwei Jahren werden die Daten in der Regel nicht mehr in den Geschäftsprozessen benötigt und ihr Standort und ihre Form werden in Archivdaten umgewandelt. Der Dienstleister muss sicherstellen, dass die Archivdaten mindestens 10 Jahre lang verfügbar sind und die folgenden Anforderungen erfüllen:
Erfahren Sie alles was Sie wissen müssen über die Durchführung einer GxP konformen Qualifizierung.

Erhalten Sie tiefere Einblicke von unseren Experten über die Temperaturüberwachung von pharmazeutischen Produkten.

Erfahren Sie mehr über den Ablauf der Kalibrierung und warum es überhaupt notwendig ist, einen Sensor zu kalibrieren.

we prove it.
Copyright © ELPRO-BUCHS AG. Alle Rechte vorbehalten